Du har säkert hört talas om det som kallas för en galvanisk cell, eller som man också brukar säga; ett galvaniskt element. Men vad är egentligen detta speciella typ av element? Hur fungerar det och vad är det som gör det intressant för oss att förstå detta? I denna introduktion kommer vi att gå igenom vad en galvanisk cell är och du kommer att förstå hur den är uppbyggd samt hur dessa olika byggstenar hänger samman. Det kan låta som riktigt komplicerade ämnen, men du kommer att upptäcka att en galvanisk cell egentligen är relativt enkel att förstå sig på.
Vad består egentligen denna cell av?
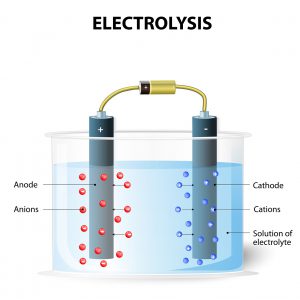
En galvanisk cell är egentligen inte så komplex att förstå som man kan tro. Cellen genererar helt enkelt en elektrisk spänning då den i sig genomgår en kemisk reaktion, något som du säkert tidigare har hört talas om i andra sammanhang. Som de flesta batterier vi brukar prata om, så är det faktiskt så att det som vi kallar för ”batterier” är just – galvaniska celler, helt enkelt. Galvaniska celler – eller batterier – är ofta återladdningsbara då batteriet fungerar i princip som en enda elektrolytisk cell. Detta är samma fenomen som vi ser i till exempel bränsleceller då väte strömmas till anoden, samtidigt som syrgas tillförs till katoden. Detta är processen som faktiskt skapar elektrisk energi – och är också en benämning på det vi brukar kalla för galvaniska celler. Det är bland annat tack vare denna omvandling i energi som vi får starkare och bättre material, och varför till exempel Nya vägräcken bättre mot korrosion. Så, i korta drag, vad ska vi då säga att en galvanisk cell är? Jo, det är egentligen vilken form som helst av kemisk energi som sedan omvandlas till elektrisk energi via antingen reduktion eller oxidation.
Vad händer i denna kemiska reaktion egentligen?
Du vet säkert att element innehåller olika poler, och dessa poler förbinds genom en viss typ av ledare. Denna ledare kan vara något i stil med en koppartråd och det den gör är att skapa en elektrisk ström från den negativa polen till den positiva polen i just detta element. Denna ström löses upp till ten positiva polen, och det som utvecklas sedan är rent väte. Varje enskilt element fungerar givetvis lite olika, helt beroende på vilka ämnen man har inblandat i denna reaktion och vilket antal volt som man jobbar med. Det vanligaste när man pratar i dessa termer är spänningar på cirka 1.5 volt, men det finns även olika sorter och varianter som kan bildas genom att göra multipler av till exempel spänningar som ligger på 1.5 volt. Även den fysiska formen på själva galvaniska batteriet kan ändras och anpassas beroende på vad man ska använda det till.